Συγγραφέας:
Christy White
Ημερομηνία Δημιουργίας:
8 Ενδέχεται 2021
Ημερομηνία Ενημέρωσης:
1 Ιούλιος 2024
Περιεχόμενο
- Για να πας
- Μέθοδος 1 από 3: Μέρος 1: Κατανόηση των κελυφών ηλεκτρονίων
- Μέθοδος 2 από 3: Μέρος δεύτερο: Εύρεση ηλεκτρονίων Valence σε μέταλλα, εκτός από τα μέταλλα μετάβασης
- Μέθοδος 3 από 3: Μέρος τρίτο: Εύρεση Ηλεκτρονίων Valence σε Μεταβατικά Μέταλλα
- Συμβουλές
- Απαιτήσεις
Τα ηλεκτρόνια σθένους βρίσκονται στο εξωτερικό περίβλημα ενός στοιχείου. Ο αριθμός των ηλεκτρονίων σθένους σε ένα άτομο καθορίζει τον τύπο του χημικού δεσμού που μπορεί να σχηματίσει αυτό το στοιχείο. Ο καλύτερος τρόπος για να μάθετε τον αριθμό των ηλεκτρονίων σθένους είναι να χρησιμοποιήσετε τον περιοδικό πίνακα των στοιχείων.
Για να πας
Μέθοδος 1 από 3: Μέρος 1: Κατανόηση των κελυφών ηλεκτρονίων
 Ο Περιοδικός Πίνακας των Στοιχείων. Αυτός είναι ένας πίνακας με χρωματικούς κωδικούς, όπου σε κάθε κελί εμφανίζεται ένα στοιχείο με τον ατομικό αριθμό και 1 έως 3 γράμματα ως σύμβολο.
Ο Περιοδικός Πίνακας των Στοιχείων. Αυτός είναι ένας πίνακας με χρωματικούς κωδικούς, όπου σε κάθε κελί εμφανίζεται ένα στοιχείο με τον ατομικό αριθμό και 1 έως 3 γράμματα ως σύμβολο.  Βρείτε τον ατομικό αριθμό του στοιχείου. Ο ατομικός αριθμός είναι πάνω ή δίπλα στο σύμβολο του στοιχείου. Για παράδειγμα: Το βόριο (Β) έχει ατομικό αριθμό 5, που σημαίνει ότι έχει 5 πρωτόνια και 5 ηλεκτρόνια.
Βρείτε τον ατομικό αριθμό του στοιχείου. Ο ατομικός αριθμός είναι πάνω ή δίπλα στο σύμβολο του στοιχείου. Για παράδειγμα: Το βόριο (Β) έχει ατομικό αριθμό 5, που σημαίνει ότι έχει 5 πρωτόνια και 5 ηλεκτρόνια.  Σχεδιάστε μια απλή αναπαράσταση ενός ατόμου και τοποθετήστε τα ηλεκτρόνια σε τροχιά γύρω από τον πυρήνα. Αυτές οι θέσεις εργασίας ονομάζονται επίσης όστρακα ή επίπεδα ενέργειας. Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να βρίσκονται στο ίδιο κέλυφος είναι σταθερός και τα κελύφη γεμίζονται από την εσωτερική έως την εξωτερική τροχιά.
Σχεδιάστε μια απλή αναπαράσταση ενός ατόμου και τοποθετήστε τα ηλεκτρόνια σε τροχιά γύρω από τον πυρήνα. Αυτές οι θέσεις εργασίας ονομάζονται επίσης όστρακα ή επίπεδα ενέργειας. Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να βρίσκονται στο ίδιο κέλυφος είναι σταθερός και τα κελύφη γεμίζονται από την εσωτερική έως την εξωτερική τροχιά. - K Shell (εσωτερικό): 2 ηλεκτρόνια το πολύ.
- L Shell: μέγιστο 8 ηλεκτρόνια.
- M Shell: μέγιστο 18 ηλεκτρόνια.
- N Shell: Μέγιστο 32 ηλεκτρόνια.
- O Shell: Μέγιστο 50 ηλεκτρόνια.
- P Shell (εξωτερικό): 72 ηλεκτρόνια το πολύ.
 Βρείτε τον αριθμό των ηλεκτρονίων στο εξωτερικό κέλυφος. Αυτά είναι τα ηλεκτρόνια σθένους.
Βρείτε τον αριθμό των ηλεκτρονίων στο εξωτερικό κέλυφος. Αυτά είναι τα ηλεκτρόνια σθένους. - Όταν το κέλυφος σθένους είναι γεμάτο, το στοιχείο είναι σταθερό.
- Εάν το κέλυφος σθένους δεν είναι γεμάτο, τότε το στοιχείο είναι αντιδραστικό, πράγμα που σημαίνει ότι μπορεί χημικά να συνδεθεί με το άτομο ενός άλλου στοιχείου. Κάθε άτομο μοιράζεται τα ηλεκτρόνια σθένους σε μια προσπάθεια να γεμίσει το κέλυφος σθένους.
Μέθοδος 2 από 3: Μέρος δεύτερο: Εύρεση ηλεκτρονίων Valence σε μέταλλα, εκτός από τα μέταλλα μετάβασης
 Αριθμήστε κάθε στήλη του περιοδικού πίνακα, από 1 έως 18. Το υδρογόνο (H) βρίσκεται στην κορυφή της στήλης 1 και το ήλιο (He) στην κορυφή της στήλης 18. Αυτές είναι οι διαφορετικές ομάδες στοιχείων.
Αριθμήστε κάθε στήλη του περιοδικού πίνακα, από 1 έως 18. Το υδρογόνο (H) βρίσκεται στην κορυφή της στήλης 1 και το ήλιο (He) στην κορυφή της στήλης 18. Αυτές είναι οι διαφορετικές ομάδες στοιχείων.  Δώστε σε κάθε σειρά έναν αριθμό, από 1 έως 7. Αυτές είναι οι περίοδοι των στοιχείων και αντιστοιχούν στον αριθμό των κελυφών ή στα επίπεδα ενέργειας ενός ατόμου.
Δώστε σε κάθε σειρά έναν αριθμό, από 1 έως 7. Αυτές είναι οι περίοδοι των στοιχείων και αντιστοιχούν στον αριθμό των κελυφών ή στα επίπεδα ενέργειας ενός ατόμου. - Το υδρογόνο (H) και το ήλιο (He) και τα δύο έχουν 1 κέλυφος, ενώ το Francium (Fr) έχει 7.
- Οι λανθανίδες και τα ακτινίδια ομαδοποιούνται και παρατίθενται κάτω από τον κύριο πίνακα. Όλες οι λανθανίδες ανήκουν στην Περίοδο 6, Ομάδα 3 και όλες οι ακτινίδες ανήκουν στην Περίοδο 7, Ομάδα 3.
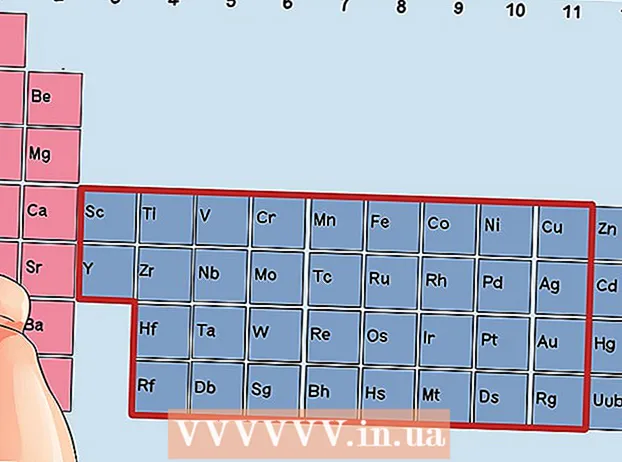
 Εντοπίστε ένα στοιχείο που δεν είναι μεταβατικό μέταλλο. Τα μέταλλα μετάβασης είναι στις ομάδες 3 έως 12. Οι αριθμοί ομάδων των άλλων μετάλλων υποδεικνύουν τον αριθμό των ηλεκτρονίων σθένους.
Εντοπίστε ένα στοιχείο που δεν είναι μεταβατικό μέταλλο. Τα μέταλλα μετάβασης είναι στις ομάδες 3 έως 12. Οι αριθμοί ομάδων των άλλων μετάλλων υποδεικνύουν τον αριθμό των ηλεκτρονίων σθένους. - Ομάδα 1: 1 ηλεκτρόνιο σθένους
- Ομάδα 2: 2 ηλεκτρόνια σθένους
- Ομάδα 13: 3 ηλεκτρόνια σθένους
- Ομάδα 14: 4 ηλεκτρόνια σθένους
- Ομάδα 15: 5 ηλεκτρόνια σθένους
- Ομάδα 16: 6 ηλεκτρόνια σθένους
- Ομάδα 17: 7 ηλεκτρόνια σθένους
- Ομάδα 18: 8 ηλεκτρόνια σθένους - εκτός από το Ήλιο, το οποίο έχει 2
Μέθοδος 3 από 3: Μέρος τρίτο: Εύρεση Ηλεκτρονίων Valence σε Μεταβατικά Μέταλλα
 Βρείτε ένα στοιχείο από τις ομάδες 3 έως 12, τα μεταβατικά μέταλλα.
Βρείτε ένα στοιχείο από τις ομάδες 3 έως 12, τα μεταβατικά μέταλλα. Προσδιορίστε τον αριθμό των ηλεκτρονίων σθένους με βάση τον αριθμό της ομάδας. Αυτοί οι αριθμοί ομάδων αντιστοιχούν σε έναν πιθανό αριθμό ηλεκτρονίων σθένους.
Προσδιορίστε τον αριθμό των ηλεκτρονίων σθένους με βάση τον αριθμό της ομάδας. Αυτοί οι αριθμοί ομάδων αντιστοιχούν σε έναν πιθανό αριθμό ηλεκτρονίων σθένους. - Ομάδα 3: 3 ηλεκτρόνια σθένους
- Ομάδα 4: 2 έως 4 ηλεκτρόνια σθένους
- Ομάδα 5: 2 έως 5 ηλεκτρόνια σθένους
- Ομάδα 6: 2 έως 6 ηλεκτρόνια σθένους
- Ομάδα 7: 2 έως 7 ηλεκτρόνια σθένους
- Ομάδα 8: 2 ή 3 ηλεκτρόνια σθένους
- Ομάδα 9: 2 ή 3 ηλεκτρόνια σθένους
- Ομάδα 10: 2 ή 3 ηλεκτρόνια σθένους
- Ομάδα 11: 1 ή 2 ηλεκτρόνια σθένους
- Ομάδα 12: 2 ηλεκτρόνια σθένους
Συμβουλές
- Τα μεταβατικά μέταλλα μπορούν να έχουν κελύφη σθένους που δεν είναι εντελώς γεμάτα. Ο προσδιορισμός του ακριβούς αριθμού των ηλεκτρονίων σθένους σε μέταλλα μετάπτωσης απαιτεί ορισμένες αρχές της κβαντικής θεωρίας που δεν εμπίπτουν στο πεδίο αυτού του εγγράφου.
Απαιτήσεις
- Περιοδικός πίνακας των στοιχείων
- Μολύβι
- Χαρτί