Συγγραφέας:
Louise Ward
Ημερομηνία Δημιουργίας:
11 Φεβρουάριος 2021
Ημερομηνία Ενημέρωσης:
28 Ιούνιος 2024

Περιεχόμενο
Το μέγεθος ενός ατόμου είναι τόσο μικρό που είναι δύσκολο να μετρηθεί με ακρίβεια ο ατομικός αριθμός μιας χημικής ένωσης. Για να είναι σε θέση να μετρήσουν με ακρίβεια μια ποσότητα ουσιών, οι επιστήμονες χρησιμοποιούν μια μονάδα γραμμομορίων για να αντιπροσωπεύουν έναν καθορισμένο αριθμό ατόμων. Ένα γραμμομόριο ουσίας ορίζεται ως ισοδύναμο με τον αριθμό ατόμων άνθρακα που περιέχονται σε 12 γραμμάρια του 12 ισότοπου άνθρακα, που είναι περίπου 6.022 x 10 άτομα. Αυτή η τιμή ονομάζεται αριθμός Avogadro ή σταθερά Avogadro. Αυτό αναφέρεται επίσης ως ο αριθμός ατόμων σε 1 mole οποιουδήποτε στοιχείου και 1 mol της μάζας μιας ουσίας ονομάζεται μοριακή μάζα αυτής της ουσίας.
Βήματα
Μέθοδος 1 από 2: Υπολογίστε τη μοριακή μάζα ενός στοιχείου
Ορισμός της μοριακής μάζας. Η μοριακή μάζα μιας ουσίας είναι η μάζα (σε γραμμάρια) ενός γραμμομορίου αυτής της ουσίας. Για τον υπολογισμό της γραμμομοριακής μάζας ενός στοιχείου, πολλαπλασιάστε την ατομική του μάζα με τα γραμμάρια συντελεστή μετατροπής ανά mol (g / mol).
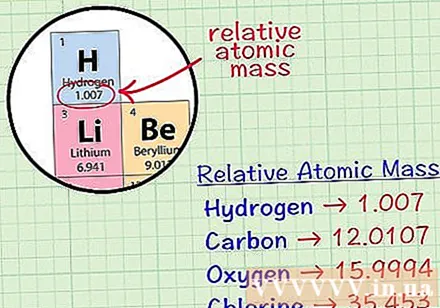
Βρείτε το μέσο κυβικό άτομο ενός στοιχείου. Το μέσο άτομο μάζας ενός στοιχείου είναι η μέση μάζα, σε ατομικές μονάδες, σε ένα δείγμα που περιλαμβάνει όλα τα ισότοπα αυτού του στοιχείου. Αυτές οι πληροφορίες δίνονται συχνά στον περιοδικό πίνακα στοιχείων. Εντοπίζοντας ένα στοιχείο, μπορείτε να βρείτε ένα μέσο κυβικό άτομο γραμμένο ακριβώς κάτω από το χημικό σύμβολο του στοιχείου. Αυτή η τιμή δεν είναι ακέραιος, αλλά αριθμός με δεκαδικά.- Για παράδειγμα, με υδρογόνο, το μέσο άτομο μάζας είναι 1,007. Το μέσο κυβικό άτομο άνθρακα είναι 12.0107. Το μέσο άτομο μάζας οξυγόνου είναι 15,9994. το χλώριο έχει μέση ατομική μάζα 35.453.

Πολλαπλασιάστε το μέσο άτομο μάζας με τη σταθερά μοριακής μάζας. Η μονάδα μοριακού ολισθήματος ορίζεται ως 0,001 κιλό ανά γραμμομόριο, ή 1 γραμμάριο ανά γραμμομόριο. Το προϊόν του μέσου ατόμου μάζας και η σταθερά γραμμομοριακής μάζας μετατρέπει τη μονάδα ατομικής μάζας σε γραμμάρια ανά γραμμομόριο, οπότε η γραμμομοριακή μάζα υδρογόνου θα είναι 1,007 γραμμάρια ανά γραμμομόριο, άνθρακας είναι 12. 0107 γραμμάρια ανά γραμμομόριο, οξυγόνου είναι 15.9995 γραμμάρια ανά γραμμομόριο, και αυτό του χλωρίου είναι 35.453 γραμμάρια ανά γραμμομόριο.- Ορισμένα στοιχεία υπάρχουν στη φύση ως μόρια που αποτελούνται από δύο ή περισσότερα από τα ίδια άτομα. Δηλαδή, εάν θέλετε να υπολογίσετε τη μοριακή μάζα ενώσεων που αποτελούνται από περισσότερα από ένα άτομα, όπως αέριο υδρογόνο, αέριο οξυγόνο ή αέριο χλώριο, πρέπει να προσδιορίσετε τη μέση ατομική μάζα της ένωσης και να πολλαπλασιάσετε αυτήν την τιμή. με τη σταθερά γραμμομοριακής μάζας, '' τότε '' πολλαπλασιάστε το προϊόν που μόλις βρήκατε με το 2.
- Με Η2: 1.007 x 2 = 2.014 γραμμάρια ανά mol; για ο2: 15,9994 x 2 = 31,9988 γραμμάρια ανά γραμμομόριο; και Cl2: 35,453 x 2 = 70,096 γραμμάρια ανά γραμμομόριο.
Μέθοδος 2 από 2: Υπολογίστε τη μοριακή μάζα της ένωσης

Προσδιορίστε τον συντακτικό τύπο της ένωσης. Ο συντακτικός τύπος μιας ουσίας δίνει τον ατομικό αριθμό κάθε στοιχείου που απαρτίζεται από αυτήν την ένωση. (Αυτές οι πληροφορίες είναι διαθέσιμες σε όλα τα βιβλία αναφοράς). Για παράδειγμα, ο χημικός τύπος του υδροχλωρικού οξέος είναι HCl. της γλυκόζης είναι C6Η12Ο6. Με αυτόν τον δομικό τύπο, μπορούμε να προσδιορίσουμε τον αριθμό κάθε τύπου ατόμου που αποτελεί την υπό εξέταση ένωση.- Όπου το HCl έχει ένα άτομο υδρογόνου και ένα άτομο χλωρίου.
- Μόριο σακχάρου γλυκόζης C6Η12Ο6 Υπάρχουν 6 άτομα άνθρακα, 12 άτομα υδρογόνου και 6 άτομα οξυγόνου.
Προσδιορίστε το μέσο άτομο μάζας κάθε συστατικού στοιχείου. Χρησιμοποιήστε τον περιοδικό πίνακα για να βρείτε το μέσο άτομο μάζας κάθε στοιχείου που υπάρχει στην ένωση. Το μέσο άτομο μάζας γράφεται συνήθως κάτω από το χημικό σύμβολο του στοιχείου στον περιοδικό πίνακα. Παρόμοια με τον υπολογισμό της γραμμομοριακής μάζας ενός στοιχείου, πολλαπλασιάστε το μέσο άτομο μάζας με 1 γραμμάριο / γραμμομόριο.
- Το μέσο άτομο μάζας των στοιχείων που σχηματίζουν υδροχλωρικό οξύ έχει ως εξής: υδρογόνο 1.007 g / mol και χλώριο 35.453 g / mol.
- Το μέσο άτομο μάζας των στοιχείων που απαρτίζουν το μόριο γλυκόζης είναι: άνθρακας, 12.017 g / mol; υδρογόνο, 1,007 g / mol; και οξυγόνο, 15,9995 g / mol.
Υπολογίστε τη μοριακή μάζα κάθε συστατικού στοιχείου. Ο πολλαπλασιασμός του ατόμου μάζας ενός στοιχείου με τον αριθμό των ατόμων που συμβάλλει σε μια ένωση δίνει τη μέση μάζα του στοιχείου στην ένωση.
- Στην περίπτωση του υδροχλωρικού οξέος, του υδροχλωρικού οξέος, η γραμμομοριακή μάζα του στοιχείου υδρογόνου είναι 1.007 g / mol, και αυτή του χλωρίου είναι 35.453 g / mol.
- Στην περίπτωση της γλυκόζης, C6Η12Ο6, η μοριακή μάζα κάθε στοιχείου έχει ως εξής: άνθρακα, 12.0107 x 6 = 72.0642 g / mol. υδρογόνο, 1.007 x 12 = 12.084 g / mol; οξυγόνο, 15,9995 x 6 = 95,9964 g / mol.
Άθροισμα των μοριακών μαζών των συστατικών στοιχείων. Η συνολική μοριακή μάζα των στοιχείων κομποστοποίησης είναι η μοριακή μάζα της ένωσης.Στο προηγούμενο βήμα υπολογίσαμε τη μοριακή μάζα κάθε στοιχείου που υπάρχει στην ένωση, σε αυτό το βήμα πρέπει απλώς να προσθέσουμε όλες αυτές τις τιμές μαζί.
- Η μοριακή μάζα του υδροχλωρικού οξέος είναι 1.007 + 35.453 = 36.460 g / mol. 36,46 γραμμάρια είναι η μάζα 1 mol υδροχλωρικού οξέος.
- Η μοριακή μάζα της γλυκόζης είναι 72.0642 + 12.084 + 95.9964 = 180.146 g / mol. Έτσι, κάθε mol γλυκόζης έχει μάζα 180,14 γραμμάρια.
Συμβουλή
- Αν και στις περισσότερες περιπτώσεις το μέσο άτομο μάζας καταγράφεται σε 1 μέρος 1000 (4 δεκαδικά ψηφία), στα εργαστήρια, η μοριακή μάζα μειώνεται συχνά στα 2 δεκαδικά ψηφία, μερικές φορές ακόμη λιγότερο, για μεγάλα μόρια. Επομένως, στην εργαστηριακή περίπτωση, η γραμμομοριακή μάζα του υδροχλωρικού οξέος μπορεί να γραφτεί ως 36,46 γραμμάρια ανά mol, για τη γλυκόζη 180,14 γραμμάρια ανά γραμμομόριο.
Ο, τι χρειάζεσαι
- Βιβλίο χημικής αναφοράς ή περιοδικός πίνακας στοιχείων
- Υπολογιστή