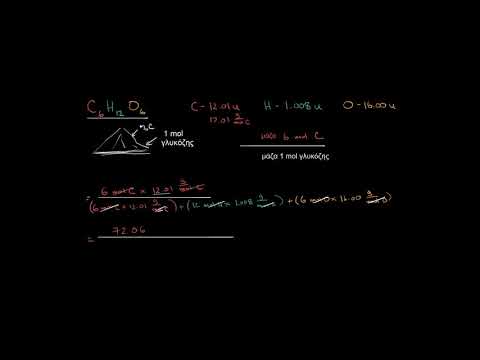
Περιεχόμενο
- Για να πας
- Μέθοδος 1 από 3: Ξεκινήστε
- Μέθοδος 2 από 3: Πώς προσδιορίζετε το ποσοστό μάζας για συγκεκριμένες μάζες
- Μέθοδος 3 από 3: Πώς καθορίζετε το ποσοστό μάζας, εάν οι μάζες δεν δίνονται
- Συμβουλές
Θα σας ζητηθεί να προσδιορίσετε το "ποσοστό μάζας" μιας συγκεκριμένης χημικής ουσίας για ένα χημικό τεστ. Πριν πανικοβληθείτε, διαβάστε πρώτα. Είναι πολύ πιο εύκολο από ό, τι ακούγεται.
Για να πας
Μέθοδος 1 από 3: Ξεκινήστε
Ένα ποσοστό κατά μάζα είναι η μάζα μιας συγκεκριμένης χημικής ουσίας διαιρούμενη με τη συνολική μάζα όλων των χημικών σε ένα διάλυμα / ένωση, εκφρασμένη ως ποσοστό. Υπάρχουν δύο τρόποι προσέγγισης αυτής της ερώτησης για το ποσοστό μάζας. Διαβάστε παρακάτω για να προσδιορίσετε ποια προσέγγιση θα ακολουθήσετε.
- Προσδιορίστε εάν η ερώτηση που πρέπει να λύσετε σας δίνει τις μάζες των χημικών ουσιών ή όχι.
- Όταν δίδονται οι μάζες. Εάν η μάζα των χημικών ουσιών έχει ήδη δοθεί στην ερώτηση, όπως με "Ποιο είναι το ποσοστό κατά μάζα 5 g υδροξειδίου του νατρίου διαλυμένο σε 100 g νερού;"Στη συνέχεια, ακολουθήστε τις οδηγίες που περιγράφονται παρακάτω στην ενότητα "Πώς να προσδιορίσετε το ποσοστό μάζας για δεδομένες μάζες".
- Εάν οι μάζες δεν δίνονται. Μερικές φορές θα σας ζητηθεί να δώσετε το ποσοστό μάζας, αλλά η μάζα των χημικών είναι άγνωστη. Σε αυτές τις περιπτώσεις θα χρησιμοποιήσετε τους χημικούς τύπους για να διαλύσετε τις χημικές μάζες. Μια τέτοια ερώτηση μπορεί να μοιάζει με αυτό, "Προσδιορίστε το ποσοστό μάζας υδρογόνου σε ένα μόριο νερού;" Εάν ναι, ακολουθήστε τις οδηγίες στην ενότητα "Πώς να προσδιορίσετε το ποσοστό μάζας, εάν δεν δίνονται οι μάζες".
Μέθοδος 2 από 3: Πώς προσδιορίζετε το ποσοστό μάζας για συγκεκριμένες μάζες
Παρακάτω θα βρείτε τα βήματα που απαιτούνται για την επίλυση μιας ερώτησης σχετικά με το ποσοστό μάζας όπου δίνεται η μάζα των χημικών ουσιών. Ένα τέτοιο ερώτημα μπορεί να μοιάζει με αυτό, "Ποιο είναι το ποσοστό κατά μάζα 5 g υδροξειδίου του νατρίου διαλυμένο σε 100 g νερού;" Τα παραδείγματα σε αυτήν την ενότητα αναλύουν αυτήν την ερώτηση.
 Υπολογίστε τη συνολική μάζα. Προσθέστε όλες τις μάζες όλων των στοιχείων στην ένωση ή το διάλυμα. Αυτό θα σας δώσει τη συνολική μάζα. Αυτός είναι ο παρονομαστής. Γράψτε τα.
Υπολογίστε τη συνολική μάζα. Προσθέστε όλες τις μάζες όλων των στοιχείων στην ένωση ή το διάλυμα. Αυτό θα σας δώσει τη συνολική μάζα. Αυτός είναι ο παρονομαστής. Γράψτε τα. - Για παράδειγμα, σε αυτό το βήμα θα κάνατε 100 g + 5 g για τη συνολική μάζα των 105 g.
 Προσδιορίστε ποια είναι η ζητούμενη χημική ουσία. Όταν σας ζητηθεί να βρείτε το "ποσοστό μάζας", σας ζητείται να προσδιορίσετε τη μάζα μιας συγκεκριμένης χημικής ουσίας (η χημική ουσία που ζητείται), ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Προσδιορίστε ποια είναι η εν λόγω χημική ουσία. Γράψτε τα. Αυτός είναι ο μετρητής σας.
Προσδιορίστε ποια είναι η ζητούμενη χημική ουσία. Όταν σας ζητηθεί να βρείτε το "ποσοστό μάζας", σας ζητείται να προσδιορίσετε τη μάζα μιας συγκεκριμένης χημικής ουσίας (η χημική ουσία που ζητείται), ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Προσδιορίστε ποια είναι η εν λόγω χημική ουσία. Γράψτε τα. Αυτός είναι ο μετρητής σας. - Για παράδειγμα, σε αυτό το βήμα καθορίζετε ότι η ζητούμενη χημική ουσία είναι 5 g υδροξειδίου του νατρίου.
 Μερίδιο. Διαιρέστε τη μάζα της ζητούμενης χημικής ουσίας, που βρίσκεται στο βήμα "Προσδιορισμός της ζητούμενης χημικής ουσίας", με τη συνολική μάζα όπως υπολογίζεται στο "Υπολογισμός της συνολικής μάζας". Το αποτέλεσμα αυτής της διαίρεσης είναι η μάζα.
Μερίδιο. Διαιρέστε τη μάζα της ζητούμενης χημικής ουσίας, που βρίσκεται στο βήμα "Προσδιορισμός της ζητούμενης χημικής ουσίας", με τη συνολική μάζα όπως υπολογίζεται στο "Υπολογισμός της συνολικής μάζας". Το αποτέλεσμα αυτής της διαίρεσης είναι η μάζα. - Για παράδειγμα, σε αυτό το βήμα, διαιρείτε 5 g (μάζα υδροξειδίου του νατρίου) με 105 (ολική μάζα) για να πάρετε τον λόγο μάζας, 0,04761.
 Υπολογίστε το ποσοστό. Πολλαπλασιάστε την αναλογία της μάζας που βρέθηκε με 100. Αυτό δίνει το ποσοστό μάζας.
Υπολογίστε το ποσοστό. Πολλαπλασιάστε την αναλογία της μάζας που βρέθηκε με 100. Αυτό δίνει το ποσοστό μάζας. - Για παράδειγμα, σε αυτό το βήμα πολλαπλασιάζετε 0,04761 επί 100 για να λάβετε 4,761%. Έτσι, το ποσοστό μάζας 5 γραμμαρίων υδροξειδίου του νατρίου που διαλύεται σε 100 γραμμάρια νερού είναι 4,761%.
Μέθοδος 3 από 3: Πώς καθορίζετε το ποσοστό μάζας, εάν οι μάζες δεν δίνονται
Παρακάτω θα βρείτε τα βήματα που απαιτούνται για την επίλυση μιας ερώτησης σχετικά με τα ποσοστά μάζας όπου οι χημικές μάζες δεν δίνονται. Ένα τέτοιο ερώτημα μπορεί να μοιάζει με αυτό, "Προσδιορίστε το ποσοστό μάζας υδρογόνου σε ένα μόριο νερού;Τα παραδείγματα σε αυτήν την ενότητα περιγράφουν αυτό το πρόβλημα.
 Διαβάστε τους παρακάτω ορισμούς. Για να μπορέσετε να υπολογίσετε το ποσοστό μάζας σε μια τέτοια δήλωση, θα πρέπει να κατανοήσετε τις χημικές έννοιες παρακάτω.
Διαβάστε τους παρακάτω ορισμούς. Για να μπορέσετε να υπολογίσετε το ποσοστό μάζας σε μια τέτοια δήλωση, θα πρέπει να κατανοήσετε τις χημικές έννοιες παρακάτω. - Σύνθετα υφάσματα. Μια ένωση σχηματίζεται συνδυάζοντας δύο ή περισσότερα διαφορετικά χημικά στοιχεία. Αυτά τα στοιχεία συγκρατούνται μαζί με ομοιοπολικούς δεσμούς ή ιοντικούς δεσμούς. Τα στοιχεία σε σύνθετα υλικά μπορούν να διαχωριστούν ξανά με χημική αντίδραση.
- Για παράδειγμα. Το υδρογόνο και το οξυγόνο είναι διαφορετικά χημικά στοιχεία. Ένα μόριο νερού είναι επομένως μια σύνθετη ουσία επειδή αποτελείται από δύο άτομα υδρογόνου και ένα άτομο οξυγόνου.
- Χημικοί τύποι. Μια σύνθετη ουσία μπορεί να αναφέρεται σε συντομευμένη μορφή. Αυτό ονομάζεται χημικός τύπος. Ένας χημικός τύπος λαμβάνει επίσης υπόψη τη σχετική ποσότητα κάθε ατόμου σε μια ένωση.
- Για παράδειγμα. Ο χημικός τύπος του νερού αποτελείται από ένα «Η» για το υδρογόνο και ένα «Ο» για το οξυγόνο. Δεδομένου ότι υπάρχουν δύο άτομα υδρογόνου σε κάθε άτομο οξυγόνου σε ένα μόριο νερού, ο χημικός τύπος του νερού πρέπει να αποτελείται από δύο Η ανά Ο. Έτσι, ο χημικός τύπος του νερού γράφεται ως H2O.
- Η γραμμομοριακή αναλογία. Η σχετική ποσότητα ενός τύπου ατόμου σε σύγκριση με εκείνη ενός άλλου τύπου ατόμου σε μια ένωση ονομάζεται αριθμός γραμμομορίων. Μπορείτε να το βρείτε κοιτάζοντας τον χημικό τύπο μιας ένωσης.
- Για παράδειγμα. Ο χημικός τύπος του νερού είναι H2O. Με την αποσύνθεση αυτού του τύπου, γνωρίζουμε ότι η γραμμομοριακή αναλογία υδρογόνου και οξυγόνου σε ένα μόριο νερού είναι ίση με 2: 1.
- Σύνθετα υφάσματα. Μια ένωση σχηματίζεται συνδυάζοντας δύο ή περισσότερα διαφορετικά χημικά στοιχεία. Αυτά τα στοιχεία συγκρατούνται μαζί με ομοιοπολικούς δεσμούς ή ιοντικούς δεσμούς. Τα στοιχεία σε σύνθετα υλικά μπορούν να διαχωριστούν ξανά με χημική αντίδραση.
 Γράψτε τον χημικό τύπο. Ίσως έχουν δοθεί οι χημικοί τύποι, αλλά αν δεν συμβαίνει αυτό, πρώτα γράψτε τους χημικούς τύπους κάθε ζητούμενης ένωσης. Εάν δίνονται οι χημικοί τύποι, μπορείτε να παραλείψετε αυτό το βήμα και να συνεχίσετε με το βήμα "Προσδιορισμός της μάζας κάθε στοιχείου".
Γράψτε τον χημικό τύπο. Ίσως έχουν δοθεί οι χημικοί τύποι, αλλά αν δεν συμβαίνει αυτό, πρώτα γράψτε τους χημικούς τύπους κάθε ζητούμενης ένωσης. Εάν δίνονται οι χημικοί τύποι, μπορείτε να παραλείψετε αυτό το βήμα και να συνεχίσετε με το βήμα "Προσδιορισμός της μάζας κάθε στοιχείου". - Για παράδειγμα, σε αυτό το βήμα πρέπει να γράψετε τη χημική φόρμουλα του νερού ως H2O.
 Καθορίζει τη μάζα κάθε στοιχείου. Αναζητήστε το μοριακό βάρος κάθε στοιχείου στον χημικό τύπο στον περιοδικό πίνακα. Γράψτε τα.
Καθορίζει τη μάζα κάθε στοιχείου. Αναζητήστε το μοριακό βάρος κάθε στοιχείου στον χημικό τύπο στον περιοδικό πίνακα. Γράψτε τα. - Για παράδειγμα, σε αυτό το βήμα ψάχνετε το μοριακό βάρος του οξυγόνου, 15.9994; και το μοριακό βάρος του υδρογόνου, 1.00794.
 Πολλαπλασιάστε τις μάζες με τη γραμμομοριακή αναλογία. Προσδιορίστε πόσα γραμμομόρια βρίσκονται σε κάθε στοιχείο της ένωσης. Πολλαπλασιάστε τη μοριακή μάζα με τη γραμμομοριακή αναλογία. Γράψτε τα.
Πολλαπλασιάστε τις μάζες με τη γραμμομοριακή αναλογία. Προσδιορίστε πόσα γραμμομόρια βρίσκονται σε κάθε στοιχείο της ένωσης. Πολλαπλασιάστε τη μοριακή μάζα με τη γραμμομοριακή αναλογία. Γράψτε τα. - Για παράδειγμα, σε αυτό το βήμα, η γραμμομοριακή αναλογία υδρογόνου και οξυγόνου σε νερό είναι 2: 1.Επομένως, πολλαπλασιάζετε τη μοριακή μάζα του υδρογόνου με 2.100794 X 2 = 2.01588. και αφήστε τη μοριακή μάζα οξυγόνου ως έχει, 15.9994.
 Υπολογίστε τη συνολική μάζα. Προσθέστε τη συνολική μάζα όλων των στοιχείων στην ένωση σας. Βεβαιωθείτε ότι χρησιμοποιείτε τις μάζες από το βήμα "Πολλαπλασιάστε τις μάζες με το γραμμομοριακό λόγο" για να λάβετε υπόψη τις σωστές αναλογίες γραμμομορίων. Γράψτε τα. Αυτός θα είναι ο παρονομαστής σας.
Υπολογίστε τη συνολική μάζα. Προσθέστε τη συνολική μάζα όλων των στοιχείων στην ένωση σας. Βεβαιωθείτε ότι χρησιμοποιείτε τις μάζες από το βήμα "Πολλαπλασιάστε τις μάζες με το γραμμομοριακό λόγο" για να λάβετε υπόψη τις σωστές αναλογίες γραμμομορίων. Γράψτε τα. Αυτός θα είναι ο παρονομαστής σας. - Για παράδειγμα, σε αυτό το βήμα, προσθέτετε 2.01588 (η μάζα 2 mol ατόμων υδρογόνου) έως 15.9994 (η μάζα 1 mol ατόμων οξυγόνου) και λαμβάνετε 18.01528.
 Προσδιορίστε το ζητούμενο χημικό. Όταν σας ζητείται να υπολογίσετε το "ποσοστό κατά μάζα", σας ζητείται να προσδιορίσετε τη μάζα μιας συγκεκριμένης χημικής ουσίας (η χημική ουσία που ζητείται) ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Προσδιορίστε το ζητούμενο χημικό. Γράψτε τα. Αυτός είναι ο παρονομαστής.
Προσδιορίστε το ζητούμενο χημικό. Όταν σας ζητείται να υπολογίσετε το "ποσοστό κατά μάζα", σας ζητείται να προσδιορίσετε τη μάζα μιας συγκεκριμένης χημικής ουσίας (η χημική ουσία που ζητείται) ως ποσοστό της συνολικής μάζας όλων των στοιχείων. Προσδιορίστε το ζητούμενο χημικό. Γράψτε τα. Αυτός είναι ο παρονομαστής. - Για παράδειγμα, σε αυτό το βήμα ανακαλύπτετε ότι η χημική ουσία που ζητείται είναι υδρογόνο.
 Μερίδιο. Διαιρέστε τη μάζα της ζητούμενης χημικής ουσίας από το βήμα "Προσδιορισμός της ζητούμενης χημικής ουσίας" με τη συνολική μάζα που υπολογίζεται στο "Υπολογισμός της συνολικής μάζας". Αυτός ο υπολογισμένος αριθμός είναι ο λόγος μάζας.
Μερίδιο. Διαιρέστε τη μάζα της ζητούμενης χημικής ουσίας από το βήμα "Προσδιορισμός της ζητούμενης χημικής ουσίας" με τη συνολική μάζα που υπολογίζεται στο "Υπολογισμός της συνολικής μάζας". Αυτός ο υπολογισμένος αριθμός είναι ο λόγος μάζας. - Για παράδειγμα, σε αυτό το βήμα, διαιρείτε το 2.01588 (τη μάζα των ατόμων υδρογόνου) με το 18.01528 (συνολική μάζα ενός μορίου νερού). Αυτό σας δίνει μια αναλογία μάζας 0,1189.
 Υπολογίστε το ποσοστό. Πολλαπλασιάστε την προκύπτουσα αναλογία μάζας από το βήμα "Διαίρεση" με 100. Αυτό θα σας δώσει την απάντηση, το ποσοστό μάζας.
Υπολογίστε το ποσοστό. Πολλαπλασιάστε την προκύπτουσα αναλογία μάζας από το βήμα "Διαίρεση" με 100. Αυτό θα σας δώσει την απάντηση, το ποσοστό μάζας. - Για παράδειγμα, σε αυτό το βήμα πολλαπλασιάζετε 0,1189 με 100 για να λάβετε 11,18%. Το ποσοστό μάζας των ατόμων υδρογόνου σε ένα μόριο νερού είναι 11,18%.
Συμβουλές
- Βεβαιωθείτε ότι ο χημικός τύπος σας είναι ισορροπημένος στο βήμα "Γράψτε τον χημικό τύπο". Εάν δοθεί ο χημικός τύπος, θα πρέπει να είναι ισορροπημένος. Ωστόσο, εάν σας ζητήθηκε πρώτα να λύσετε μια χημική εξίσωση για να δημιουργήσετε τον προαναφερθέντα χημικό τύπο, βεβαιωθείτε ότι είναι ισορροπημένη πριν προσδιορίσετε το ποσοστό μάζας.